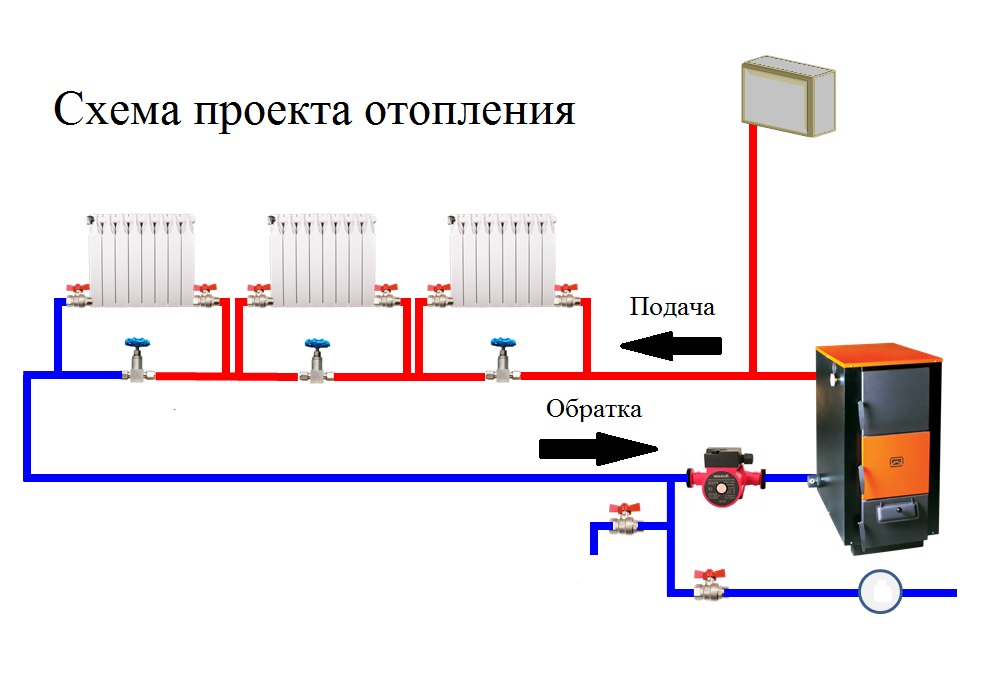
Отопление на воде: Принцип устройства водяной системы отопления
Как отапливать дом бесплатно водой – можно ли сделать отопление на воде
Вода состоит из водорода и кислорода, Н2О. Водород Н2 — летучий гремучий газ, при горении выделяет в 2 раза больше энергии, чем обычный природный газ (тяжелый углеводород), находящийся в магистралях и газовых печках. Колоссальная теплота сгорания! Кислород О2 – природный окислитель, с ним горит все что угодно, например, дрова, в результате получаем углекислый газ СО2…
В общем, идея не нова – расщепить воду на 2Н2 и О2 и получить компоненты для весьма и весьма теплотворного топлива, которое горит лучше (выделяет энергии больше) чем все, что сжигали в отоплении домов ранее. Отсюда и заманчивость процесса – как создать котел в доме на воде, или двигатель работающий бесплатно…
Основной выход из технической сложности, который предлагают изобретатели всех мастей, – подмешивать воду в обычное топливо, или предельно сложно в смесительных барокамерах, толи предельно просто – разболтав в бутылке…
Посмотрим на последние достижения. Особенно интересно для владельцев домов – смешивать отработанное масло 4% и 96% воды – чем не «бесплатно вообще», ведь отработку можно слить и с личного автомобиля. Вот что транслируют центральные телеканалы…
Особенно интересно для владельцев домов – смешивать отработанное масло 4% и 96% воды – чем не «бесплатно вообще», ведь отработку можно слить и с личного автомобиля. Вот что транслируют центральные телеканалы…
Обычная печка с использование воды в качестве топлива
Воду можно использовать как топливо и в обычной печи или в обыкновенном твердотопливном котле, которые уже установлены повсюду — так говорят некоторые создатели видео. Оригинальная идея – подавать пар воды прямо в плазму горящего топлива, или дров или угля… Причем сложного оборудования для этого не нужно.
В топку кладется металлический бак со множеством мелких отверстий на верхней грани, через которые будет выходить пар при кипении воды. Имеется также горловина для заливки с закручивающейся пробкой. При закипании пар будет попадать прямо в самую горячую зону.
По свидетельствам очевидцев с использованием вечного полена (так называют бак) пропадает черная сажа (кислород дожигает углерод?), появляются длинные языки пламени (сгорает водород?). В общем, по крайней мере, — поле для экспериментов. Но не только обычную печь можно модернизировать (?) подобным образом, но и обычный двигатель – читайте далее…
В общем, по крайней мере, — поле для экспериментов. Но не только обычную печь можно модернизировать (?) подобным образом, но и обычный двигатель – читайте далее…
Что рассказывают центральные телеканалы об отоплении домов водой
Есть конструкция намного сложнее чем бак с водой в топке, но изобретатель добился всеобщего внимания. Как отопить дом водой и отработкой, — несколько сложный агрегат…
Но может нужно вложиться по максимуму в оборудование, чтобы топить за копейки? — по мнению этих авторов. Смесь воды (90%) и отработки (10%) в «бурбуляции» при «турбулепеции» делает свое дело – пламя, прям скажем, чудесное, главное — из ниоткуда…
Как можно бесплатно ездить на воде
Есть множество видеосвидетельств, когда горит смесь из воды и солярки. Это смешивается в простой бутылке, поджигается — горит! Появляется некоторый треск, но горение имеется, при этом самого топлива просто стало больше – на объем добавленной воды. Если залить это чудодейство в дизельный грузовик, то грузовик заводится и «дырынчит»…
Это смешивается в простой бутылке, поджигается — горит! Появляется некоторый треск, но горение имеется, при этом самого топлива просто стало больше – на объем добавленной воды. Если залить это чудодейство в дизельный грузовик, то грузовик заводится и «дырынчит»…
Автор следующего ролика делает все в несколько более скромных размерах. Для экспериментов использования воды в качестве топлива для двигателя используется мокик – мопед. Но ведь большое произрастает из малого, не так ли? Сегодня мокик, завтра – «Жигули», послезавтра — ….
Можно ли топить водой? — Как обманули
Но если взглянуть на окружающий нас мир, то можно обнаружить, что вода в качестве топлива нигде и никак не используется поблизости, — только лишь в приведенных выше роликах , и во множестве других киносъемок, и в заявлениях псевдоизобретателей. Чаще это делается с целью «как-то подзаработать».
Чаще это делается с целью «как-то подзаработать».
Что же происходит на самом деле?
- Вода смешанная с соляркой горит с треском – горит солярка, капли воды вскипают и создают микровзрывы, энерговыделение пониженной в несколько раз.
- Дизель на солярке с водой тарахтит – грузовик не сможет делать обычную работу – мало энергии, а сам агрегат ускоренно выходит со строя.
- Бак в печке – испарение воды от нагрева забирает много энергии у топлива, связывает сажу в смолистые отложения, охлаждает печь, создается эффект, как будто топят сырыми дровами.
- Таинственный суперагрегат на смеси отработанного масла с водой – просто развлекательное видео, было бы о чем поговорить….
Как горит вода на самом деле
На расщепление воды на Н2 и О2 расходуется на 30% больше энергии, чем выделяется при обратном соедиеннии этих составляющих, т.е. при сжигании водорода. Поэтому на воде до сих пор ничего не работает, и водой нигде не отапливают. В качестве эксперимента давным давно был создан автомобиль с электролизной установкой на борту, которая расщепляла воду, используя огромные аккумуляторы, а водород сжигался в двигателе внутреннего сгорания. Автомобиль двигался! На чистой воде! Но потреблял на движение энергии в разы больше, чем если бы это был просто бензин…
В качестве эксперимента давным давно был создан автомобиль с электролизной установкой на борту, которая расщепляла воду, используя огромные аккумуляторы, а водород сжигался в двигателе внутреннего сгорания. Автомобиль двигался! На чистой воде! Но потреблял на движение энергии в разы больше, чем если бы это был просто бензин…
В пламени же вода не расщепляется, а просто испаряется, забирая огромное количество энергии на свое преобразование из жидкого состояния в газообразное. Поэтому на официальном уровне вода – это пожаротушащее средство.
Вода в системе отопления. — Азбука Тепла
Что такое жесткость воды? Классификация воды по классу жесткости.
Различный суммарный уровень растворенных в воде солей кальция Са и магния Mg характеризует так называемую общую жесткость воды. Гидрокарбонаты магния и калия образуют карбонатную (временную) жесткость, которая полностью устраняется при длительном кипячении воды, но переходит в нерастворимый осадок с выделением углекислого газа.
Налет или накипь на поверхностях теплообмена, равно как и углекислый газ, ведущий к интенсивной коррозии металлов, являются факторами, существенно влияющими на эффективность парового оборудования, прежде всего мощных котлов. Поэтому умягчение воды требует последующего удаления образующегося углекислого газа и удаления нерастворимых солей.
Углекислый газ высвобождается при нагреве воды и удаляется воздухоотводчиками. Нерастворимые соли удаляются из систем периодической промывкой котлов.
Свойство воды омывать поверхности, не оставляя налета, хорошо известно в быту. Мягкая вода хорошо мылится, и после нее остается только естественный слой жира, выделяемый поверхностным слоем кожи. При жесткой воде остается остается ощущение некоторого дополнительного неестественного покрова.
Измеряется общая жесткость в разных странах в своих единицах:
— ppm (или мг/литр) CaCO3;
— dH (немецкий градус жесткости) — Германия;
— f (французский градус жесткости) — Франция;
— мг-экв/л.
При жесткости до 4 мг-экв/л вода считается мягкой;
от 4 до 8 мг-экв/л — средней жесткости,
от 8 до 12 мг-экв/л — жесткой;
свыше 12 мг-экв/л — особо жесткой.
ОЦЕНКА ЖЕСТКОСТИ ВОДЫ.
Для оценки жесткости воды, показания прибора преобразуйте в соответствии со следующим правилом:
1 dH (Немецкий градус) = 17.8 ppm
1 f (Французский градус) = 10 ppm
1 мг-экв/л = 50.05 ppm
Влияние воды и растворенных в ней веществ на организм человека.
Роль воды в организме человека. Человек состоит из воды на 70-80%; мозг человека — на 85%; эмбрион — на 95%; меньше всего воды в костях — 30%. Вода — основной растворитель в человеческом организме, в ней переносятся все вещества — соли, кислород, ферменты, гормоны. Поэтому все вещества, вырабатываемые нашим организмом, водорастворимы. При растворении веществ очень важен химический состав воды, ведь чем больше посторонних примесей в воде, тем хуже она растворяет вещества. (Например, водопроводная вода на 1/5 часть уже занята посторонними примесями и человеку остается только 4/5 от выпитого объема).
Все органические соединения, находящиеся в воде, можно условно разделить на мелкие (размер молекулы — меньше 100 килодальтон) и крупные (размер молекулы — от 100 килодальтон). Наиболее опасны для человека крупные органические соединения, которые на 90% являются канцерогенами или мутагенами. Наиболее опасны хлорорганические соединения, образующиеся при кипячении хлорированной воды, т.к. они являются сильными канцерогенами, мутагенами и токсинами. Остальные 10% крупной органики в лучшем случае нейтральны в отношении организма. Полезных для человека крупных органических соединений, растворенных в воде, всего 2-3 (это ферменты, необходимые в очень малых дозах). Воздействие органики начинается непосредственно после питья. В зависимости от дозы это может быть 18-20 дней или, если доза большая, 8-12 месяцев.
Содержащиеся в воде ионы тяжелых металлов, попадая в наш организм, остаются там навсегда, вывести их можно только с помощью белков молока и белых грибов. Достигая определенной концентрации в организме, они начинают свое губительное воздействие — вызывают отравления, мутации. Кроме того, что сами они отравляют организм человека, они еще и чисто механически засоряют его — ионы тяжелых металлов оседают на стенках тончайших систем организма и засоряют почечные каналы, каналы печени, таким образом снижая фильтрационную способность этих органов. Соответственно, это приводит к накоплению токсинов и продуктов жизнедеятельности клеток нашего организма, т.е. самоотравление организма, т.к. именно печень отвечает за переработку ядовитых веществ, попадающих в наш организм, и продуктов жизнедеятельности организма, а почки — за их выведение наружу. К тяжелым металлам относятся Pb (свинец), Al (алюминий), Mn (марганец), Si (кремний), Fe (железо), Se (селен), Zn (цинк), Hg (ртуть), Cd (кадмий).
Кроме того, что сами они отравляют организм человека, они еще и чисто механически засоряют его — ионы тяжелых металлов оседают на стенках тончайших систем организма и засоряют почечные каналы, каналы печени, таким образом снижая фильтрационную способность этих органов. Соответственно, это приводит к накоплению токсинов и продуктов жизнедеятельности клеток нашего организма, т.е. самоотравление организма, т.к. именно печень отвечает за переработку ядовитых веществ, попадающих в наш организм, и продуктов жизнедеятельности организма, а почки — за их выведение наружу. К тяжелым металлам относятся Pb (свинец), Al (алюминий), Mn (марганец), Si (кремний), Fe (железо), Se (селен), Zn (цинк), Hg (ртуть), Cd (кадмий).
Марганец забивает канальцы нервных клеток. Снижается проводимость нервного импульса, как следствие повышается утомляемость, сонливость, снижается быстрота реакции, работоспособность, появляются головокружение, депрессивные, подавленные состояния. Особенно опасны отравления марганцем у детей и эмбрионов (когда женщина беременна) — приводит к идиотии. Из 100 детей, матери которых во время беременности подверглись отравлению марганцем, 96-98 рождаются идиотами. Есть также теория, что токсикозы на ранних и поздних сроках беременности вызываются марганцем. В водопроводной воде — избыток марганца. Кроме воды марганец содержится в воздухе из-за производственных выбросов. В природе марганец затем накапливается в грибах и растениях, попадая таким образом в пищу. Марганец почти невозможно вывести из организма; очень тяжело диагностировать отравление марганцем, т.к. симптомы очень общие и присущи многим заболеваниям, чаще же всего человек просто не обращает на них внимания.
Из 100 детей, матери которых во время беременности подверглись отравлению марганцем, 96-98 рождаются идиотами. Есть также теория, что токсикозы на ранних и поздних сроках беременности вызываются марганцем. В водопроводной воде — избыток марганца. Кроме воды марганец содержится в воздухе из-за производственных выбросов. В природе марганец затем накапливается в грибах и растениях, попадая таким образом в пищу. Марганец почти невозможно вывести из организма; очень тяжело диагностировать отравление марганцем, т.к. симптомы очень общие и присущи многим заболеваниям, чаще же всего человек просто не обращает на них внимания.
Алюминий так же оказывает общее отравляющее и засоряющее действие на организм человека. В водопроводной воде его избыток связан с тем, что излишки железа на водозаборе удаляют сульфатом алюминия. Реагируя с ионами железа, сульфат алюминия дает нерастворимый осадок, в который выпадает, в принципе и железо, и алюминий, но в реальности в воде остается и железо, и алюминий.
Селен необходим человеку в очень малых дозах, при малейшем превышении дозы он превращается в канцероген, мутаген и токсин. Человеку можно безопасно восполнить недостаток селена с помощью специальных минеральных комплексов; селен также содержится в морской капусте.
Железо бывает в природе в трех состояниях — молекулярное железо F0(когда оно куском), Fe2+ — необходимо в организме человека как переносчик кислорода (в молекуле гемоглобина 4 иона F2+) и F3+ — вредное для человека — оно и есть ржавчина. Железо необходимо организму человека, но только в определенной пропорции и в виде иона F2+. В водопроводной воде большой избыток железа, т.к. в природной воде его много, плюс ржавые трубы, по которым течет вода к потребителям.
Кальций необходим в организме человека для строения костной ткани (зубы, кости), мышечной ткани (мышцы, мышца сердца), поддержания проводящей функции нервной ткани. При избытке кальций нейтрален по отношению к организму человека, однако, это снижает качество воды — соли кальция образуют накипь и мутность воды.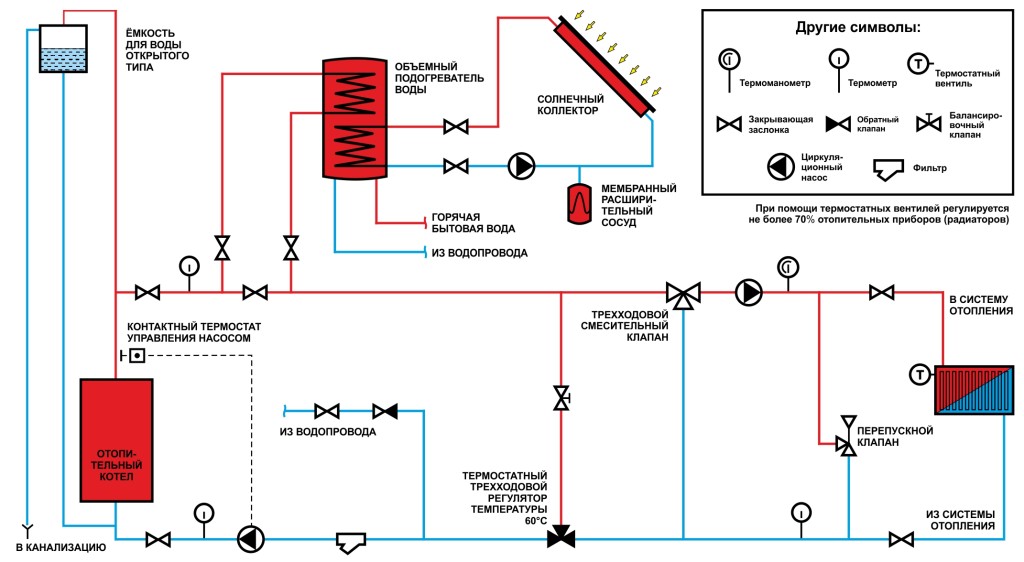
Магний необходим для нормальной деятельности нервных клеток. Однако, его количество в воде должно быть ограниченно, т.к.
при избытке он действует на подобие марганца — засоряет канальцы нервных клеток, только он менее активен и проще выводится из организма.
Калий также необходим для нормальной жизнедеятельности организма, т.к. является компонентом калий-натриевого насоса. Калий-натриевый насос — это структура на мембране каждой клетки, благодаря которой в клетку проникают вещества из межклеточной жидкости, а из клетки выводятся продукты ее жизнедеятельности. Кроме того, особенно важен калий для сердечно-сосудистой деятельности, т.к. он нормализует давление крови и работу сердца.
Жесткость воды.
Жесткость во
ды определяется концентрацией ионов щелочноземельных металлов. К ним относятся преимущественно хлориды, сульфаты, гидрокарбонаты и т. д. По жесткости вода дополнительно подразделяется на:
• мягкую (до 7 °dH),
• средней жесткости (до 14 °dH),
• жесткую (до 21 °dH) и очень жесткую (> 21 °dH).
Чем выше степень жесткости, тем больше ионов содержится в воде. В настоящее время обозначение °dH (“градус немецкой жесткости”) вышло из употребления и применяется ммоль/л.
Для численного выражения жёсткости воды указывают концентрацию в ней катионов кальция и магния. Рекомендованная единица системы СИ для измерения концентрации — моль на кубический метр (моль/м³), однако, на практике для измерения жёсткости чаще используется миллимоль на литр (ммоль/л). В России для измерения жёсткости чаще используется нормальная концентрация ионов кальция и магния, выраженная в миллиграмм-эквивалентах на литр (мг-экв/л). Один мг-экв/л соответствует содержанию в литре воды 20,04 миллиграмм Ca2+ или 12,16 миллиграмм Mg2+ (атомная масса делённая на валентность). Числовое значение жесткости, выраженное в молях на кубический метр равно числовому значению жесткости, выраженному в миллиграмм эквивалентах на литр (или кубический дециметр), т.е.: 1моль/м3=1ммоль/л=1мг-экв/л=1мг-экв/дм3. Иногда указывают концентрацию, отнесённую к единице массы, а не объёма, особенно, если температура воды может изменяться или если вода может содержать пар, что приводит к существенным изменениям плотности. В разных странах использовались (иногда используются до сих пор) различные внесистемные единицы — градусы жёсткости.
В разных странах использовались (иногда используются до сих пор) различные внесистемные единицы — градусы жёсткости.
В СССР до 1952 года использовали градусы жёсткости, совпадавшие с немецкими.
Азбука Тепла
Водонагреватели — Производственная компания Rheem
США
Закон о снижении инфляции и налоговые льготы – Подробнее
Америка
- США
- Канада
- Мексика
- Боливия
- Бразилия
- Чили
- Колумбия
- Аргентина
Ближний Восток, Азия и Океания
- Азия
- Китай
- Индонезия
- Сингапур
- Филиппины
- Вьетнам
- Малайзия
- Ближний Восток и Африка
- Австралия
- Новая Зеландия
Выберите страну
США США Канада Мексика Боливия Бразилия Чили Колумбия Аргентина Азия Китай Индонезия Сингапур Филиппины Вьетнам Малайзия Ближний Восток и Африка Австралия Новая ЗеландияРешения для водяного отопления США
Английский enИспанский эс
Сервис + Запросы цен
ВАША Вода
Нагревающий раствор
наши сервисы
Экспертные и профессиональные услуги
Жилищные услуги
— Диагностика водонагревателя + ремонт
— Замена водонагревателя
— Профилактическое обслуживание
— Сантехника (ТОЛЬКО Иллинойс)
— Электрика (ТОЛЬКО Иллинойс)
Коммерческие услуги
— Ремонт водонагревателя
— Замена водонагревателя
— Профилактическое обслуживание
— Сантехника (ТОЛЬКО Иллинойс)
— Электрика (ТОЛЬКО Иллинойс)
Круглосуточная служба*
24/7/365 Аварийный водонагреватель
*Доступно в большинстве штатов; исключения для гарантийного обслуживания
Гарантия на обслуживание и продукцию
30-дневная гарантия USWHPRO на работу
1 год гарантии производителя на большинство деталей
Наши обязательства перед вами
Проверка биографических данных
Все наши технические специалисты проходят проверку биографических данных сторонней организацией.
Служба качества
Наши технические специалисты прошли обучение у производителя и имеют сертификаты.
Дружелюбная поддержка
Наша диспетчерская команда всегда рядом, чтобы обеспечить бесперебойную работу. Вы всегда найдете необходимую помощь.
Прозрачность
Честность — лучшая политика. Вот почему мы стремимся создавать образовательные ресурсы.
Штаты, которые мы обслуживаем
Что говорят клиенты…
-
«У меня был водонагреватель Richmond, который вышел из строя в Локпорте, штат Иллинойс, и я позвонил в американское водонагревательное оборудование. Большой опыт от начала до конца. Я должен особенно упомянуть Мартина, техника, который вышел. время, когда он оставил самого профессионального и знающего техника, который у меня был в моем доме, и быстро починил мой обогреватель.
 Он задал вопросы и провел несколько тестов, чтобы исправить это с первого раза.Я бы хотел, чтобы Мартин работал над другими вещами в моем доме, он был бы на моем быстром наборе».
Он задал вопросы и провел несколько тестов, чтобы исправить это с первого раза.Я бы хотел, чтобы Мартин работал над другими вещами в моем доме, он был бы на моем быстром наборе».ГРЭГ К. (ЯНВАРЬ 2022 г.)
Кнопка
«Эта компания пришла и отремонтировала мой водонагреватель сегодня. У нас был Мартин, и он был просто феноменален! Он запустил наш водонагреватель и запустил его примерно за 10 минут, и был НАСТОЛЬКО добрым, профессиональным и дружелюбным. Это был очень хороший опыт. с этой компанией! Он даже проделал весь этот путь сюда в канун Рождества, чтобы исправить это для нас. Я не могу рекомендовать эту компанию достаточно! Они фантастические, и мы всегда будем выбирать и рекомендовать их!!»
САВАННА (ДЕКАБРЬ 2021)
Кнопка
«Мой годовалый обогреватель Rheem вышел из строя.
 Позвонил [Rheem, который] сказал, что США сделают ремонт. Сейл вышел, с ним был газовый контроль, починил, снова горячая вода. Отличная компания для работы, Сейл тоже отличный.»
Позвонил [Rheem, который] сказал, что США сделают ремонт. Сейл вышел, с ним был газовый контроль, починил, снова горячая вода. Отличная компания для работы, Сейл тоже отличный.»ЛАРРИ Г. (ОКТЯБРЬ 2021 г.)
Кнопка
«Я совершил ошибку, наняв местную компанию для установки моего водонагревателя, и эта компания сделала ужасную работу. Я позвонил Риму для получения гарантийной поддержки, и они отправили Мартина с U.S. Water Heating Solutions. Мартин не только самый знающий сантехник, которого я когда-либо встречал. встретился, он хотел убедиться, что у меня есть вся верная информация, и что это не просто его слова и 30-летний опыт работы с сантехникой и водонагревателями Rheem».
БЛЕЙН Н. (ИЮЛЬ 2021)
Кнопка
«Они пришли в крайнем случае в субботу после того, как мы остались без денег из другой компании.
 Сухая, потому что мы не могли принять душ 🙂 Они ответили быстро, Эрин была ТАК милой, Майк был общительным и быстрым. Через 30 минут мы были готовы идти. В маске и профессионально, счастливы, как могут быть. Мы немного доплатили за субботнее обслуживание, но оно того стоило».
Сухая, потому что мы не могли принять душ 🙂 Они ответили быстро, Эрин была ТАК милой, Майк был общительным и быстрым. Через 30 минут мы были готовы идти. В маске и профессионально, счастливы, как могут быть. Мы немного доплатили за субботнее обслуживание, но оно того стоило».САРА Х. (МАРТ 2021 г.)
Кнопка
«US. Water Heating Solutions связались со мной и сразу же связались со мной по поводу утечки. Мы договорились о встрече, и Кевин, техник по обслуживанию в юго-восточном районе Висконсина, профессионально устранил утечку. Определенно рекомендую их услуги. Спасибо большое.»
ЛЕАНН П.
Пуговица
«Отличная работа! Сделали вовремя и все что должны были сделать!! Пять звезд!»
ДЖЕННИФЕР С.
.jpg)
Кнопка
«У меня начал течь водонагреватель, и Кевин вышел, чтобы посмотреть. Мой водонагреватель нужно было полностью заменить, и, к счастью, он был на гарантии. Кевин вышел и заменил его в тот же день. Очень профессионально, и он знал, что говорил о. Очень рекомендую его!»
МОРГАН С.
Кнопка
«Вышел и установил новый котел… отличная работа… Кирк и Кевин»
МАЙКЛ М.
Кнопка
-
«Наш новый водонагреватель перестал работать. Джек из U.S. Water Heating Solutions пришел посмотреть, определил проблему и устранил ее.
 Он был очень пунктуален, очень профессионален, вежлив и очень хорошо осведомлен. 5 звезд Джеку»
Он был очень пунктуален, очень профессионален, вежлив и очень хорошо осведомлен. 5 звезд Джеку»КАПИЛ М.
Бренды WE Service
20 000+
Сервисные звонки
2000+
Установка водяного нагрева
901351000+
Коммерческие рабочие места
13+
Государства обслуживают
Посетите наш блог, чтобы узнать больше о своем водном нагревании и оставаться в курсе.
Водонагреватель 201: Знакомство с коммерческими водонагревателями
Эрин Трибулец • 16 декабря 2022 г.
Давайте будем честными: водонагреватели — секретный спасательный круг пищевой, косметической и гостиничной индустрии; Вот почему мы хотим, чтобы вы были как можно лучше осведомлены о коммерческом водонагревателе вашего бизнеса и о том, что вам следует делать, если вы обнаружите, что ваш бизнес без горячей воды.